Mikroskopiske huller i hjernen fører måske til Parkinsons
Et giftigt protein danner dynamiske porer i hjernecellers membran – og det kan være nøglen til at forstå, hvordan Parkinsons sygdom udvikler sig. Det viser ny forskning fra iNANO på Aarhus Universitet, hvor forskere har brugt en banebrydende metode til at følge molekylære angreb i realtid.

Parkinsons sygdom begynder ofte i det små. En let rysten i hånden. En anelse stivhed. Men langsomt dør hjernecellerne, og motorikken forværres. Hvorfor det sker, har længe været et mysterium – men nu er forskere kommet et vigtigt skridt nærmere svaret.
I centrum står proteinet α-synuclein, som i raske hjerner spiller en rolle i nervecellernes kommunikation. Ved Parkinsons sygdom begynder det dog at opføre sig anderledes: det klumper sig sammen i giftige strukturer.
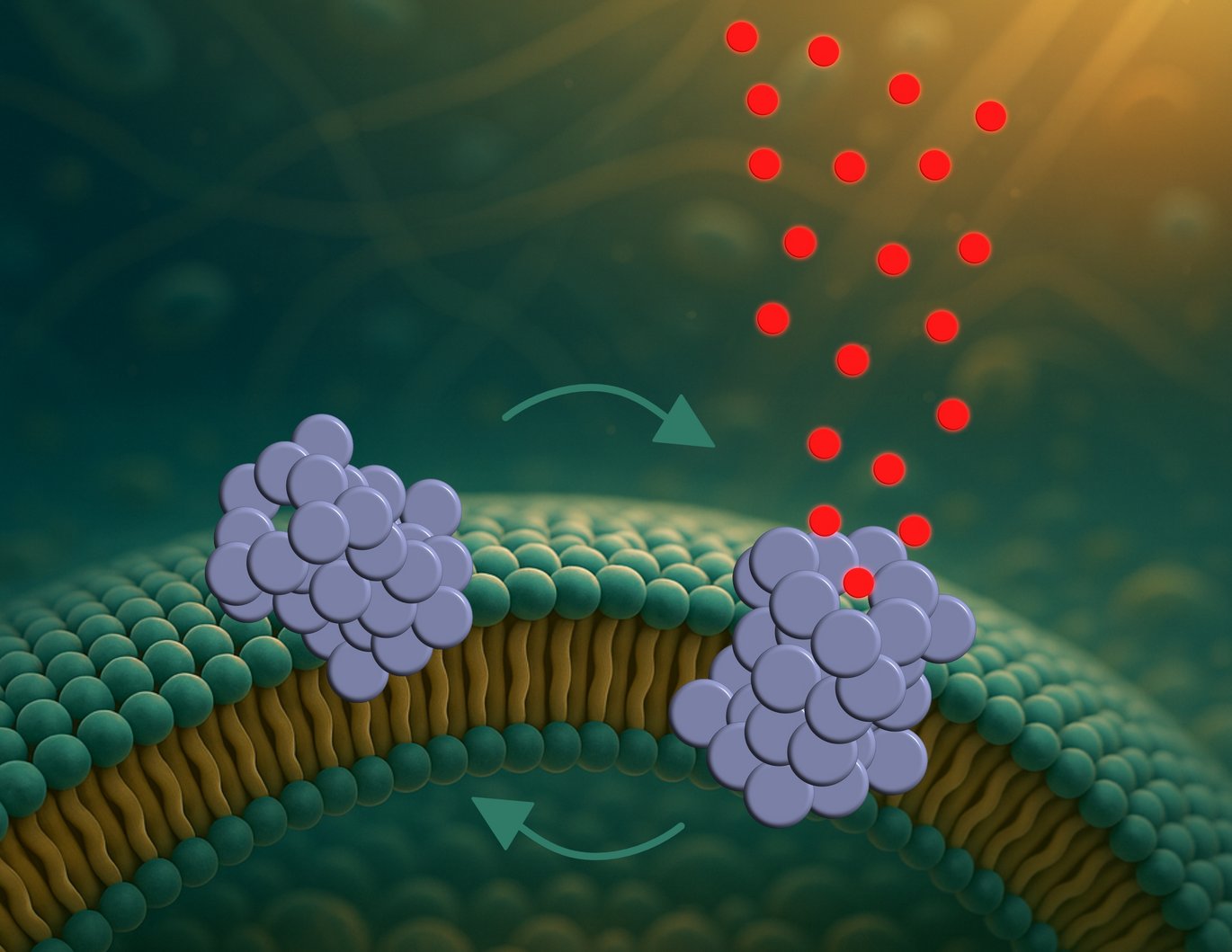
Hidtil har det store fokus ligget på kæmpestore strukturer kaldet fibriller, da disse har været synlige i hjernevæv fra parkinsonpatienter. Der findes mindre og mere giftige strukturer, såkaldte oligomerer, som ikke er lige så godt forstået. Og ifølge det nye studie er det netop disse, der borer mikroskopiske huller i nervecellernes membraner.
Studiet er netop offentliggjort i det prestigefulde ACS nano, der udgives af The American Chemical Society.
Små svingdøre i cellerne
”Vi har for første gang direkte observeret, hvordan de her oligomerer danner porer – og hvordan porerne opfører sig,” siger Mette Galsgaard Malle, der er postdoc ved både Aarhus Universitet og Harvard University.
Porerne dannes i tre trin: Først binder oligomererne sig til cellemembranen, især på buede områder. Derefter trænger de delvist ind – og til sidst dannes en pore, der tillader molekyler at passere og kan ændre i cellernes balance. Men porerne er ikke statiske huller. De åbner og lukker sig hele tiden som små svingdøre.
”Den dynamiske adfærd kan være med til at forklare, hvorfor cellerne ikke dør med det samme,” forklarer Bo Volf Brøchner, ph.d.-studerende og førsteforfatter på studiet.
”Hvis porerne havde stået åbne hele tiden, ville cellerne formentlig gå til meget hurtigere. Men fordi de åbner og lukker, kan nogle af cellens egne pumper måske midlertidigt opretholde balancen.”
Molekylær film i slowmotion
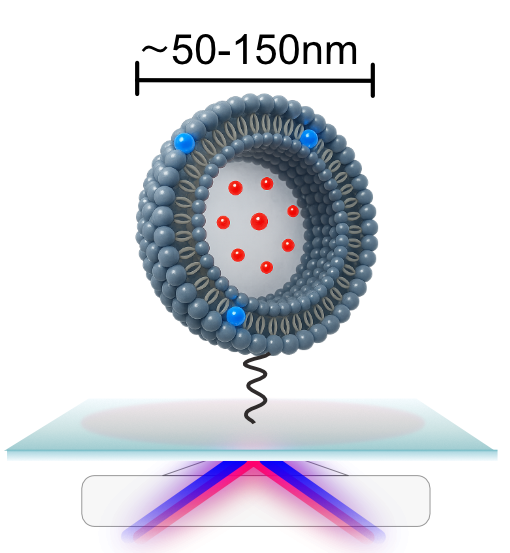
Det er første gang, nogen har kunnet observere denne dynamik i realtid. Det skyldes en nyudviklet metode: En enkelt-vesikel-analyse-platform, der gør det muligt at følge interaktionen mellem én enkelt vesikel og ét enkelt protein.
Vesikler er små kunstige bobler, der efterligner cellemembraner, og fungerer som modeller for rigtige celler.
”Det er som at se en molekylær film i slowmotion,” forklarer Mette Galsgaard Malle. ”Platformen giver os ikke bare indsigt i, hvad der sker – den kan også bruges til at teste, hvordan forskellige molekyler påvirker processen. Det gør den til et oplagt værktøj til at screene mulige lægemidler.”
Lang vej til behandling
Faktisk har forskerne allerede testet såkaldte nanobodies – små delelementer fra antistoffer – som er udviklet til specifikt at binde sig til netop disse oligomerer. De virker som lovende kandidater til diagnostik, fordi de er ekstremt selektive. Men som behandling? Her er der længere vej.
”Nanobodies hæmmer ikke pore-dannelsen,” siger Bo Volf Brøchner. ”Men de kan måske bruges til at påvise oligomererne i meget tidlige stadier af sygdommen. Det er afgørende, fordi Parkinson typisk først opdages, når cellerne allerede er begyndt at dø.”
Porerne dannes ikke tilfældigt, viser studiet. De foretrækker visse typer membraner – og især dem, der ligner dem i mitokondrier, cellens energifabrikker. Det kan betyde, at skaden starter dér.
Én ting ad gangen
Men forskerne understreger, at studiet er lavet i modeller – ikke i levende celler. De næste skridt bliver derfor at gentage forsøgene i biologisk væv, hvor flere faktorer spiller ind.
”Vi har skabt et clean setup, hvor vi kan måle én ting ad gangen. Det er styrken ved platformen,” siger Mette Galsgaard Malle. ”Men det betyder også, at vi nu skal tage næste skridt og se, hvad der sker i mere komplekse, biologiske systemer.”
Supplerende oplysninger | |
| Vi bestræber os på, at alle vores artikler lever op til Danske Universiteters principper for god forskningskommunikation. På den baggrund er artiklen suppleret med følgende oplysninger: | |
| Finansiering | Lundbeck Fonden, Danmarks Grundforskningsfond |
| Læs mere | Den videnskabelige artikel i ACS Single-vesicle Tracking of α-Synuclein Oligomers Reveals Pore Formation by a Three-Stage Model |
| Kontakt | Postdoc Mette Galsgaard Malle iNANO, Aarhus Universitet og Wyss Institute for Biologically Inspired Engineering, Harvard Mobil: 2849 1368 Mail: malle@inano.au.dk Phd-studerende Bo Volf Brøchner INANO-MBG, Aarhus Universitet Mobil: 5041 5596 Mail: bovb@inano.au.dk |
