Nanostrukturer med øget stabilitet til udvikling af mere effektiv kræft-nanomedicin
De fleste lægemidler, der anvendes i dag, har kun én virkningsmekanisme, og det er både vanskeligt og dyrt at fremstille lægemidler med flere funktioner. Forskere i forskningscenteret CEMBID ved Aarhus Universitet har for nyligt fundet en måde at lave mere stabile nanostrukturer, der kan samle biomolekyler med forskellige funktioner, som i kombination f.eks. kan give mere effektiv kræftmedicin.

DNA har igennem årtusinder spillet en central rolle ved at opbevare hver celles genetiske information og består af strenge med en specifik sekvens af fire forskellige byggeklodser kaldet baser. Disse DNA-strenge kopieres af cellen ved hver celledeling på ekstremt velorkestreret vis, men utroligt nok så er dette sofistikerede maskineri styret af helt simple baseparringsregler.
Man har de senest år fundet ud af at udnytte disse simple regler ikke kun i forbindelse med genteknologi, men også til at konstruere brugbare DNA-nanostrukturer ved at designe DNA-strenge. Disse DNA-nanostrukturer har vist sig at have en række anvendelige biomedicinske funktioner som f.eks. at kunne transportere kræftmedicin til præcis de steder i kroppen, hvor der er brug for dem. Dette kan øge effekten af medicinen samt giver færre bivirkninger i forhold til konventionel kræftbehandling.
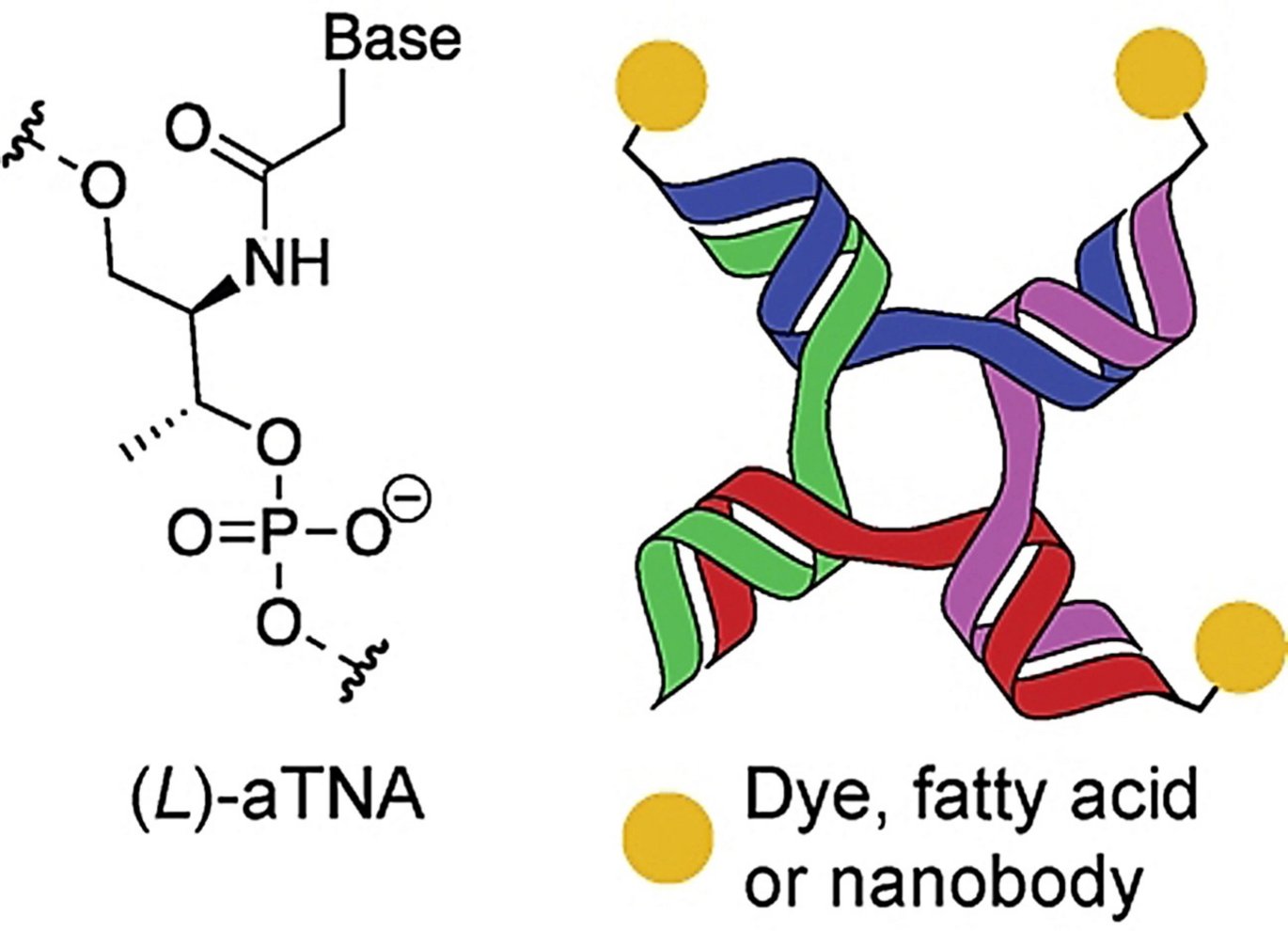
DNA-nanostrukturer anvendes også i stigende grad som et værktøj til at binde og samle biomolekyler, til multifunktionelle strukturer. Èn af disse anvendte DNA-nanostrukturer danner en forgrenet struktur med fire ender (se illustration), kaldet 4-way junctions (4WJ), der også findes naturligt.
Med særligt designede udgaver af disse 4WJ-strukturer har man f.eks. ved Harvard Medical School i Boston opnået at binde og samle forskellige antistoffer, der i kombination sørgede for at T-celler angreb aggressive kræftceller mere intensivt og dermed slog tumorere ihjel.
Forbedrede DNA-nanostrukturer med kunstige byggesten
Forskere, som er en del af Center for Multifunctional Biomolecular Drug Design (CEMBID) ved Aarhus Universitet, arbejder også på at finde nye måder at koble forskellige lægemidler for at opnå flere og mere effektive virkningsmekanismer. Forskningsgruppen, som er ledet af Professor Kurt Gothelf, har netop udgivet en artikel i det anerkendte tidsskrifte Angewandte Chemie Int. Ed. med resultater der netop involverer 4WJ-strukturer, men i en forbedret udgave. Arbejdet er udført i samarbejde med Jørgen Kjems’ og Ken Howards’ forskningsgrupper, som også er en del af CEMBID.
Nok er disse DNA-nanostrukturer (4WJ) smarte, men der er nemlig den ulempe ved DNA-strukturerne, at DNA de facto er en bionedbrydelig polymer. Det betyder at strukturerne nedbrydes hurtigere i blodet end ønsket. Derudover kan strukturerne være så store at de i sig selv aktiverer immunsystemet. Skal strukturerne kunne bruges til diagnostik eller i medicin er det afgørende at strukturerne er meget stabile, ugiftige og ikke i sig selv udløser en immunreaktion hos patienten.
Anders Märcher, der er post doc i Kurt Gothelfs forskningsgruppe og en del af CEMBID har, sammen med sine forskerkolleger, nu fundet en måde at øge stabiliteten af disse DNA-nanostrukturer. Dette har de opnået ved at bruge små kæder, kaldet oligonukleotider, af kunstige og modificerede byggesten til at danne nanostrukturen. De kunstige oligonukleotider, Märcher et al. anvender kaldes acyklisk L-threoninol-nukleinsyre (aTNA) og fungerer på samme måde og lige så godt som de naturlige byggesten i DNA. Her er det sukkermolekylet (deoxyribose) i de naturlige byggesten byttet ud med et kunstigt sukkermolekyle (acyklisk L-threoninol), der netop forstærker den overordnede struktur.
De positive resultater viste at 4WJ-strukturer med den kunstige byggesten, aTNA, er meget stabile, ikke nedbrydes i blodet, har vist sig ugiftig for celler og ikke fremkalder en uspecifik immunrespons.
Når forskerne koblede en særlig type af biomolekyler, som er kendt for at binde til en biomarkør i brystkræftceller med høj specificitet, på den nye 4WJ-struktur, viste det sig at 4WJ-strukturen kan vise sig effektiv i at lede kræft-medicin til de ønskede celler.
Desuden kunne de, ved at lave yderligere modifikationer på den nye 4WJ-strukturen, forlænge dens levetid i blodbanen og dermed også virkningen af det lægemiddel der måtte være koblet på DNA-nanostrukturen.
Forskerne forestiller sig at deres 4WJ-struktur bygget med kunstige byggeklodser både kan bruges som et redskab til at transportere lægemidler til rette position i kroppen hos en patient. Derudover ser de at den kan fungere som værdifuldt værktøj i forskning. Eksempelvis forestiller forskerne sig at effekten af forskellige kombinationer af kræft-nedbrydende biomolekyler kan screenes hurtigere og mere effektivt, således at man hurtigere kan finde frem til den mest effektive kræftbehandling.
Center for Multifunctional Biomolecular Drug Design (CEMBID)
Center for Multifunctional Biomolecular Drug Design (CEMBID) blev finansieret af Novo Nordisk Fonden med DKK 60 millioner i 2018 og løber ind til 2024.
Professor Kurt V. Gothelf står i spidsen for centeret med en baggrund inden for organisk kemi, biokonjugation og DNA-nanoteknologi, men det interdisciplinære hold af forskere ved CEMBID arbejder både inden for områderne kemi, molekylærbiologi, farmakologi og medicin.
Kollegaerne fra iNANO: Professor Jørgen Kjems og lektor Ken Howard er med til at lede centret, hvor Jørgen Kjems har stor ekspertise inden for nukleinsyre nanoteknologi og drug delivery, mens lektor Ken Howard er ekspert inden for drug delivery og farmakokinetik. Med fra Vrije Universiteit i Bruxelles er også professor Tony LaHoutte, der gennem sin store erfaring med kliniske undersøgelser af biokonjugater bidrager i forbindelse med test af de nye koblede lægemidler.
SUPPLERENDE OPLYSNINGER, HERUNDER KONTAKTOPLYSNINGER
Vi bestræber os på, at alle vores artikler lever op til Danske Universiteters principper for god forskningskommunikation. På den baggrund er artiklen suppleret med følgende oplysninger:
PUNKTER | INDHOLD OG FORMÅL |
Ekstern finansiering | Novo Nordisk Fonden (CEMBID, NNF17OC0028070) Grundforskningsfonden (CellPAT, DNRF135) |
Interessekonflikt | Forskerne erklærer, at der ingen interessekonflikter er. |
Link til videnskabelig artikel | Functionalized Acyclic (L)-Threoninol Nucleic Acid Four Way Junction with High Stability in Vitro and in Vivo. Anders Märcher, Vipin Kumar, Veronica L. Andersen, Kassem El-Chami, Thuy J.D. Nguyen, Mads K. Skaanning, Imke Rudnik-Jansen, Jesper Nielsen, Kenneth A. Howard, Jørgen Kjems og Kurt V. Gothelf Angew. Chem. Int. Ed. 2022, e202115275 https://onlinelibrary.wiley.com/doi/epdf/10.1002/anie.202115275 |
Kontaktdata | Direktør for Center for Multifunctional Biomolecular Drug Design Interdisciplinært Nanoscience Center (iNANO) & Institut for Kemi Aarhus Universitet Mail: kvg@chem.au.dk |
